DETERMINACIÓN DE LA DENSIDAD,PUNTO DE EBULLICIÓN,CONDUCTIVIDAD Y PH
|
La densidad es la
relación que existe entre la masa de una sustancia y el volumen que ocupa n
s = masa/ volumen.
·
unidades: g/cm 3 y
g/mL y g/ L para gases. n
·
Normalmente en las
tablas de densidades se reporta la temperatura a la cual se determinaron, ya
que los volúmenes de los objetos pueden cambiar con ella.
·
En el S.I. la densidad se expresa como s=
kg/ m 3
· La densidad se
maneja en forma indirecta cuando se utilizan los conceptos “pesado” y “ligero”
· Cuando en la vida
cotidiana se dice “el hierro pesa más que el aluminio”
· Se refiere a que un trozo de hierro tiene mayor masa y
por lo tanto pesa más en el mismo lugar que otro de aluminio del mismo volumen
· Otra propiedad relacionada con la densidad es la densidad
relativa : densidad de la sustancia/densidad del agua a 4°C.
|
Material
Temperatura (°C) Densidad (g/cm3)
|
|
Pb 20
11.3
|
|
Ag 20
10.4
|
|
Cu 20
8.5
|
|
Fe 20
7.7
|
|
Al 20
2.7
|
|
H2O (S) 0 0.917
|
|
H2O (l) 4 1.0
|
|
H2O (l) 25 0.997
|
|
Etanol 25
0.791
|
|
Glicerina 25
1.26
|
|
Hg 20
13.6
|
|
He 20
0.000178
|
|
H 20
0.000089
|
|
O 20
0.00143
|
|
H2O (g) 100
0.000596
|
*PUNTO
DE EBULLICIÓN:
La
temperatura de ebullición es aquella a la cual la presión
de vapor del líquido es igual a la presión externa. En este punto, el
vapor no solamente proviene de la superficie sino que también se forma en el
interior del líquido produciendo burbujas y turbulencia que es característica
de la ebullición. La temperatura de ebullición permanece constante hasta que
todo el líquido se haya evaporado.
El
punto de ebullición que se mide cuando la presión externa es de 1 atm se
denomina temperatura normal de ebullición y se sobreentiende
que los valores que aparecen en las tablas son puntos normales de ebullición.
En
el caso de sustancias puras a una presión fija, el proceso de ebullición o de
vaporización ocurre a una sola temperatura; conforme se añade calor la
temperatura permanece constante hasta que todo el líquido ha hervido.
El
punto normal de ebullición se define como el punto de ebullición a una presión
total aplicada de 101.325 kilopascales ( 1 atm); es decir, la temperatura a la
cual la presión de vapor del líquido es igual a una atmósfera. El punto de
ebullición aumenta cuando se aplica presión. Para las sustancias que hierven en
el intervalo de la temperatura ambiente, la tasa de cambio del punto de
ebullición con la temperatura ambiente, la tasa de cambio del punto de
ebullición con la temperatura es de aproximadamente 0.3º/kPa o 0.04º/mm Hg
(donde la presión es aproximadamente de una atmósfera).
El
punto de ebullición no puede elevarse en forma indefinida. Conforme se aumenta
la presión, la densidad de la fase gaseosa aumenta hasta que, finalmente, se
vuelve indistinguible de la fase líquida con la que está en equilibrio; ésta es
la temperatura crítica, por encima de la cual no existe una fase líquida clara.
METODOS
PARA DETERMINAR EL PUNTO DE EBULLICION
1)
Método General: consiste en destilar una sustancia cuyo punto de ebullición se
desea determinar, de forma tal que el bulbo del termómetro esté en contacto con
los vapores de la ebullición y con el líquido que por condensación se formará
sobre el bulbo.
2)
Técnica Operatoria: Es cuando cuyo punto de ebullición se desea determinar y se
agregan unos trocitos de piedra pómez o cerámica porosa para regular la
ebullición. Se calienta a baño maría. Cuando la temperatura permanece constante
y el líquido destila, se hace la lectura en el termómetro, que corresponde al
punto de ebullición a la presión ambiente. Se mide la presión atmosférica en el
barómetro y se anota su valor. Conviene siempre dejar que la destilación
continúe unos minutos más observando el termómetro para ver si la temperatura
permanece constante. Para líquidos cuyos puntos de ebullición sean inferiores a
100º C, se calienta el balón a baño María. Para puntos de ebullición superiores
a 100º C, se seleccionan otros baños cuya temperatura de ebullición sea, como
mínimo, 20º C mayor a la de la sustancia en ensayo.
3)
Método de Siwoloboff: Este método tiene la ventaja que requiere muy poca
cantidad de muestra. Consiste en colocar en un tubo de ensayo una pequeña
cantidad del líquido a ensayar, se introduce en el líquido un tubo capilar
cerrado a la llama en su extremo más fino, el cual irá hacia arriba. El capilar
sirve, de manómetro indicador del instante en que se igualan la presión de
vapor del líquido y la presión atmosférica
Técnica
Operatoria: Se hacen tubos capilares estirando a la llama un tubo de vidrio
fusible, se cortan de 5 a 6 cm de longitud y se cierran a la llama los extremos
afilados. Se coloca en un tubo de ensayo, aproximadamente, 5 ml del líquido
cuyo punto de ebullición se desea determinar y uno de los capilares, con el
extremo cerrado hacia arriba. Se arma el dispositivo como indica. Se calienta
en baño agitando y se observa el capilar. Al comienzo, del extremo abierto del
capilar, se desprenden algunas burbujas cuyo número aumenta rápidamente, hasta
que llega un momento en que se forma una serie continua de burbujas llamada
“rosario de burbujas”. Entonces, se lee la temperatura que indica el
termómetro y que corresponde al punto de ebullición del líquido en ensayo a la
presión atmosférica. Esta lectura se considera sólo de aproximación y no
interviene en los cálculos. Se repite la experiencia dejando enfriar el líquido
y el baño y utilizando un nuevo tubo capilar.
Corrección
de la temperatura de ebullición
En
el caso de los líquidos, la temperatura de ebullición se ve afectada por los
cambios en la presión atmosférica debidos a las variaciones en la altura. A
medida que un sitio se encuentra más elevado sobre el nivel del mar, la
temperatura de ebullición se hace menor . A una altura de 1500
m o 0.84 atm (Medellín, por ejemplo), el agua ebulle a 95 °C mientras que al
nivel del mar el agua hierve a 100 °C.
Factores
de corrección del punto de ebullición por cambios en la presión
|
Variación
en T por p = 10 mm Hg
|
||
|
Teb
normal (°C)
|
Líquidos
no polares
|
Líquidos
polares
|
|
50
|
0.380
|
0.320
|
|
60
|
0.392
|
0.330
|
|
70
|
0.404
|
0.340
|
|
80
|
0.416
|
0.350
|
|
90
|
0.428
|
0.360
|
|
100
|
0.440
|
0.370
|
|
110
|
0.452
|
0.380
|
|
120
|
0.464
|
0.390
|
|
130
|
0.476
|
0.400
|
*CONDUCTIVIDAD:
la
conductividad se evalúa la capacidad del agua para conducir la corriente
eléctrica, es una medida indirecta la cantidad de iones en solución
(fundamentalmente cloruro, nitrato, sulfato, fosfato, sodio, magnesio y
calcio). La conductividad en los cuerpos de agua dulce se encuentra primariamente
determinada por la geología del área a través de la cual fluye el agua
(cuenca).
Por
ejemplo, aguas que corren en sustrato graníticos tienden a tener menor
conductividad, ya que ese sustrato esta compuesto por materiales que no se
ionizan. Descargas de aguas residuales suelen aumentar la conductividad debido
al aumento de la concentración de Cl- , NO3 - y SO4 -2, u otros iones. Debe
tenerse en cuenta que derrames de hidrocarburos (aceites, petróleo), compuestos
orgánicos como aceites, fenol, alcohol, azúcar y otros compuestos no ionizables
(aunque contaminantes), no modifican mayormente la conductividad. La unidad
básica para medir la conductividad es el siemens por centímetro.
El agua destilada tiene una conductividad en
el rango de 0,5 a 3 µSiemens/cm (un µS1 es la millonésima parte de un Siemens).
La conductividad de nuestros sistemas continentales generalmente es baja,
variando entre 50 y 1.500 µS/cm. En sistemas dulceacuícolas, conductividades
por fuera de este rango pueden indicar que el agua no es adecuada para la vida
de ciertas especies de peces o invertebrados. Algunos efluentes industriales
pueden llegar a tener más de 10.000 µS/cm.
Es por esto que la conductividad es una medida
generalmente útil como indicador de la calidad de aguas dulces. Cada cuerpo de
agua tiene un rango relativamente constante de conductividad, que una vez
conocido, puede ser utilizado como línea de base para comparaciones con otras
determinaciones puntuales. Cambios significativos pueden ser indicadores
eventos puntuales de contaminación.
Metodología:
La determinación puede realizarse en el campo
o en el laboratorio. No olvide utilizar recipientes bien limpios para acarrear
las muestras de agua (preferentemente lávelos previamente y enjuáguelos con
agua destilada). Las muestras que sean llevadas al laboratorio para la
determinación de la conductividad, deben conservarse refrigeradas y ser
analizadas antes del primer mes desde su colecta. La conductividad será
determinada mediante la utilización de un conductímetro electrónico (fig.1), el
que genera una diferencia de voltaje entre dos electrodos sumergidos en agua.
La caída en el voltaje debida a la resistencia del agua es utilizada para
calcular la conductividad por centímetro.
Si
está disponible, utilice la solución estándar ([KCl](ac)=0,01M) para calibrar
el conductímetro. Sin exceder el máximo nivel de inmersión marcado en el
reverso del equipo (MAX LEVEL), sumerja el sensor en el recipiente con la
solución y espere que la lectura se estabilice. Si la lectura es diferente a
1.413, utilizando el pequeño destornillador ajuste el valor a 1.413 µS/cm (fig.
1). Lave con abundante agua destilada el sensor, antes de utilizarlo para
realizar la determinación. Tome el recipiente con la muestra y sumerja el
sensor sin exceder el máximo nivel de inmersión marcado en el reverso del equipo
(MAX LEVEL). Agite suavemente y espere que la lectura se estabilice.
*PH
el
pH puede definirse como una medida que expresa el grado de acidez o basicidad
de una solución en una escala que varía entre 0 y 14 (fig.1). La acidez aumenta
cuando el pH disminuye. Una solución con un pH menor a 7 se dice que es ácida,
mientras que si es mayor a 7 se clasifica como básica. Una solución con pH 7
será neutra. El valor de pH representa el menos logaritmo en base diez de la
concentración (actividad) de iones hidrógeno [H+ ]. Como la escala es
logarítmica, la caída en una unidad de pH es equivalente a un aumento de 10
veces en la concentración de H+ . Entonces, una muestra de agua con un pH de 5
tiene 10 veces más H+ que una de pH 6 y 100 veces más que una de pH 7. Fig.1:
escala de pH.
El rojo simboliza pHs ácidos, mientras el azul
básicos. Imagen tomada de Aquatox 2000
http://archive.idrc.ca/aquatox/sp/whatsnu/check.html Los cambios en la acidez
pueden ser causados por la actividad propia de los organismos, deposición
atmosférica (lluvia ácida), características geológicas de la cuenca y descargas
de aguas de desecho. El pH afecta procesos químicos y biológicos en el agua. La
mayor parte de los organismos acuáticos prefieren un rango entre 6,5 y 8,5. pHs
por fuera de este rango suele determinar disminución en la diversidad, debido
al estrés generado en los organismos no adaptados. Bajos pHs también pueden
hacer que sustancias tóxicas se movilicen o hagan disponibles para los
animales.
El
pH puede ser analizado en el campo o en el laboratorio. No olvide utilizar
recipientes bien limpios para tomar y acarrear las muestras de agua
(preferentemente lávelos previamente y enjuáguelos con agua destilada). Si la
muestra es llevada al laboratorio, la determinación debe ser realizada
preferentemente dentro de las 2 primeras horas a partir de la colecta, ya que
puede cambiar por interacción con el anhídrido carbónico (CO2) atmosférico.
Conserve las muestras refrigeradas para su transporte.
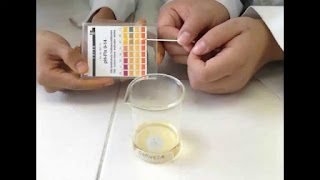
La
determinación será realizada con tirillas indicadoras. Estas simplemente se
sumergen por un instante en la muestra de agua, lo que provoca un cambio de
color.
Bibliografía
AURELIA.
(s.f.). PDF. Obtenido de PDF:
http://imasd.fcien.edu.uy/difusion/educamb/propuestas/red/curso_2007/cartillas/tematicas/Conductividad.pdf
GUILLERMO. (s.f.). PDF. Obtenido de PDF:
http://imasd.fcien.edu.uy/difusion/educamb/propuestas/red/curso_2007/cartillas/tematicas/Determinacion%20del%20pH.pdf
JUAN. (s.f.). PDF. Obtenido de PDF:
http://imasd.fcien.edu.uy/difusion/educamb/propuestas/red/curso_2007/cartillas/tematicas/Determinacion%20del%20pH.pdf
UNAM. (s.f.). PROPIEDADES FISICAS. Obtenido
de PROPIEDADES FISICAS:
http://depa.fquim.unam.mx/amyd/archivero/U1temas1.5a1.7_19118.pdf







Comentarios
Publicar un comentario